PRACTICA 16: UN INDICADOR NATURAL.
1a parte:
NOMBRE
|
NÚMERO DE LISTA
|
LINKS DE SU BLOG.
|
Lizeth Jazmín Montoya Torres
|
21
|
http://3clizethmontoyat22.blogspot.mx/
|
Salvador Osorio Gonzalez
|
22
|
http://3csalvadorosoriog23.blogspot.mx/
|
Michelle Alejandra Perez de Lara
|
23
|
http://3cmichelleperez24.blogspot.mx/
|
Mariana Valeria Pichardo Muñoz
|
24
| |
Alejandro Plascencia Romo
|
25
|
http://3calejandroplascenciar26.blogspot.mx/
|
Paula Daniela Quezada Delgado
|
26
| |
Luisa Fernanda Ramirez Andrade
| 27 |
http://3cluisaramireza28.blogspot.mx/
|
FECHA DE REALIZACIÓN:
24 de Mayo del 2016
OBJETIVO:
Obtención de un indicador natural de ácidos y bases.
Creemos que de acuerdo con las propiedades de la col morada obtendremos variaciones en la estructura de las sustancias base o ácidos, las cuales tendrán que presentar un color característico en la escala de pH.
INVESTIGACIÓN:
Escala de pH excluiva para la col morada impresa a color.

¿Que sustancia hace que la col morada pueda usarse como indicador de pH? El colorante de la col morada (brasica oleracea) se puede extraer calentando durante 5-10 minutos, una o dos hojas de la col en una taza con agua purificada. El colorante natural así obtenido es, por supuesto, totalmente comestible, por lo que se ha propuesto su uso como pigmento para medicamentos. El colorante en cuestión se llama cianidina, y tiene propiedades químicas muy interesantes pues el color azul-violeta que presenta en medio neutro (pH = 7) cambia a colores que tienden hacia el rojo en medio ácido (pH = 1-6), y a colores que en medio básico tienden hacia el verde (pH = 8-12) y al amarillo (pH = 13-14).
La Cianidina es un compuesto orgánico natural que ha sido clasificado como un flavonoide(1). Es un pigmento.
En este sentido, debemos destacar que encontramos una mayor presencia de cianidina en las pieles y cáscaras de las frutas, aunque también la podemos encontrar en la alcachofa, o en la misma col morada.La Cianidina es un compuesto orgánico natural que ha sido clasificado como un flavonoide(1). Es un pigmento.


1. Flavonoide es el término genérico con que se identifica a una serie de metabolitos secundarios de las plantas.
¿Qué otras sustancias pueden utilizarse como indicadores de pH? Un indicador de pH es una sustancia colorida que cambia de color según su forma ácida o básica, algunos indicadores de pH son de origen natural, los vegetales producen pigmentos que pueden ser indicadores de pH, la col morada contiene un pigmento muy fácil de extraer y utilizar como indicador de pH.
Las antocianinas pertenecen al grupo de compuestos químicos denominados flavonoides. Las cerezas, la col morada, pétalos de rosa roja, la cebolla morada, las hortensias, el maíz azul y muchas otras flores y frutas contienen flavonoides. Estos se pueden extraer fácilmente usando disolventes polares como el agua o el etanol ya sea por maceración de la planta, flor o fruto, o por calentamiento a baño maría o a ebullición.
Las antocianinas pertenecen al grupo de compuestos químicos denominados flavonoides. Las cerezas, la col morada, pétalos de rosa roja, la cebolla morada, las hortensias, el maíz azul y muchas otras flores y frutas contienen flavonoides. Estos se pueden extraer fácilmente usando disolventes polares como el agua o el etanol ya sea por maceración de la planta, flor o fruto, o por calentamiento a baño maría o a ebullición.

Escala de pH de petalos de rosa.
Referencias:
http://cosasdequimicos.blogspot.mx/2009/02/indicador-de-repollo-morado.html
https://tallerdeciencias.wikispaces.com/file/view/ColMorada_Alephzero.pdf
http://www.natursan.net/que-es-la-cianidina-y-para-que-sirve/
https://es.wikipedia.org/wiki/Cianidina
https://es.wikipedia.org/wiki/Flavonoide
http://es.slideshare.net/mapicapra/indicadores-de-p-h-caseros
MATERIAL:
- Un recipiente de metal de medio litro de capacidad.
- Dispositivo de calentamiento (soporte universal, anillo de fierro, rejilla de alambre, mechero bunsen)
- Colador mediano
- Embudo de plástico.
- Botella de plástico de 1 litro vacía.
SUSTANCIAS:
- 4 hojas de col morada.
- Agua de la llave.
PROCEDIMIENTO:
- Partan las hojas de col morada en trozos pequeños.
- Pongan a calentar 400 ml de agua en el recipiente.
- Cuando el agua rompa el hervor vacíen la col morada en el recipiente. Déjenlo hervir por 5 minutos o hasta que el agua tome un color púrpura.
- Esperen a que se enfríe la mezcla y con ayuda del embudo vacíenla en la botella de plástico, tápenla y refrigeren.
OBSERVACIONES (IMÁGENES Y DESCRIPCIÓN):
CONCLUSIÓN:
Esta parte de la practica no la realizamos nosotros, sino que la maestra la hizo y solamente nos trajo el indicador de la col morada, el cual es el líquido morado que se utiliza en la segunda parte para detectar cada una de las sustancias.
Esta parte de la practica no la realizamos nosotros, sino que la maestra la hizo y solamente nos trajo el indicador de la col morada, el cual es el líquido morado que se utiliza en la segunda parte para detectar cada una de las sustancias.
El cual se ve de la manera como esta en la foto de arriba.
Y es el que hace cambiar a las sustancias de color.
2a parte:
NOMBRE
|
NÚMERO DE LISTA
|
LINKS DE SU BLOG.
|
Lizeth Jazmín Montoya Torres
|
21
|
http://3clizethmontoyat22.blogspot.mx/
|
Salvador Osorio Gonzalez
|
22
|
http://3csalvadorosoriog23.blogspot.mx/
|
Michelle Alejandra Perez de Lara
|
23
|
http://3cmichelleperez24.blogspot.mx/
|
Mariana Valeria Pichardo Muñoz
|
24
| |
Alejandro Plascencia Romo
|
25
|
http://3calejandroplascenciar26.blogspot.mx/
|
Paula Daniela Quezada Delgado
|
26
| |
Luisa Fernanda Ramirez Andrade
| 27 |
http://3cluisaramireza28.blogspot.mx/
|
FECHA DE REALIZACIÓN:
24 de Mayo del 2016
OBJETIVO:
Determinar si una sustancia es ácida o básica utilizando el indicador natural de col morada.HIPÓTESIS:
Se piensa que con la ayuda de la escala de pH los colores que se obtengan en cada una de las sustancias serán mucho mas fácil de identificar, y así podremos ubicar mejor cual es un ácido y cual una base, ya que cada sustancia reaccionara de una manera diferente con el indicador, y también creemos que obtendremos varios colores.
INVESTIGACIÓN:
¿Qué significa pH? Investiga el pH que debe tener la piel de tu cara, tu estómago, tu saliva y tu sudor y qué sucede si éste llega a alterarse.
El pH:
Indica el grado de acidez o basicidad de una solución, éste se mide por la concentración del ión hidrógeno; los valores de pH están comprendidos en una escala de 0 a 14, el valor medio es 7; el cual corresponde a solución neutra por ejemplo agua, los valores que se encuentran por debajo de 7 indican soluciones ácidas y valores por encima de 7 corresponde a soluciones básicas o alcalinas.Debido a que el pH indica la medida de la concentración del ión hidronio en una solución, se puede afirmar entonces, que a mayor valor del pH, menor concentración de hidrógeno y menor acidez de la solución.


pH de la cara:
La piel es una sofisticada estructura multitarea que realiza multitud de roles esenciales para nuestro bienestar general.
El papel más importante que juega es el de barrera protectora entre nuestro cuerpo y el mundo exterior, siendo el pH de la piel uno de sus mecanismos de protección clave. El pH de nuestra piel está en constante peligro debido a diversos agentes agresivos externos como la contaminación, los cambios de temperatura y los productos químicos agresivos. Proteger la piel con productos de calidad superior ayuda a mantener su valor de pH óptimo, de manera que pueda realizar su papel vital, protegernos.
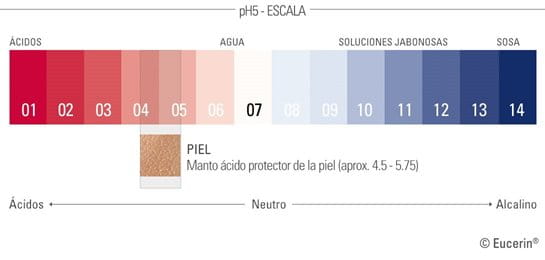
El manto protector de la piel es ligeramente ácido
El valor de pH óptimo de la piel en la mayor parte de la cara y el cuerpo oscila entre 4,7 y 5,75. Un pH de 7, el del agua pura, es calificado como neutro. Cualquier valor inferior recibiría la categoría de ácido y si fuera superior nos referiríamos a él como alcalino, de manera que el pH natural de la piel podría ser considerado como ácido. Este pH ligeramente ácido es consecuencia del manto ácido, la parte acuosa de la película hidrolipídica que protege las capas externas de nuestra piel.
El valor de pH óptimo de la piel en la mayor parte de la cara y el cuerpo oscila entre 4,7 y 5,75. Un pH de 7, el del agua pura, es calificado como neutro. Cualquier valor inferior recibiría la categoría de ácido y si fuera superior nos referiríamos a él como alcalino, de manera que el pH natural de la piel podría ser considerado como ácido. Este pH ligeramente ácido es consecuencia del manto ácido, la parte acuosa de la película hidrolipídica que protege las capas externas de nuestra piel.
pH del estomago:
El volumen normal del líquido estomacal es de 20 a 100 mL y el pH es ácido (1.5 a 3.5). En algunos casos, estos números se convierten a producción ácida real en unidades de miliequivalentes por hora.
Nota: los rangos de los valores normales pueden variar ligeramente según el laboratorio que realice el examen. Hable con su proveedor de atención médica acerca del significado de los resultados específicos de su examen.
Anormalidades:
El aumento en los niveles de gastrina puede causar un incremento en la secreción de ácido y puede conducir a la formación de úlceras (síndrome de Zollinger-Ellison).
La presencia de bilis en el estómago indica regurgitación del material desde el intestino delgado (duodeno). También puede suceder después de una extirpación quirúrgica de parte del estómago.
Un pH demasiado bajo puede dar lugar a condiciones ulcerosas, mientras que un pH anormalmente alto impide el desglose adecuado de los alimentos.
Nota: los rangos de los valores normales pueden variar ligeramente según el laboratorio que realice el examen. Hable con su proveedor de atención médica acerca del significado de los resultados específicos de su examen.
Anormalidades:
El aumento en los niveles de gastrina puede causar un incremento en la secreción de ácido y puede conducir a la formación de úlceras (síndrome de Zollinger-Ellison).
La presencia de bilis en el estómago indica regurgitación del material desde el intestino delgado (duodeno). También puede suceder después de una extirpación quirúrgica de parte del estómago.
Un pH demasiado bajo puede dar lugar a condiciones ulcerosas, mientras que un pH anormalmente alto impide el desglose adecuado de los alimentos.

pH de la saliva:
El pH de la saliva es aproximadamente entre 6,5 y 7 y está compuesta de agua y de iones como el sodio, el cloro o el potasio, y enzimas que ayudan a la degradación inicial de los alimentos, cicatrización, protección contra infecciones bacterianas e incluso funciones gustativas.
El pH de la saliva en ayunas suele ser neutro, pero disminuye tras la exposición de azucares.
Varia de acuerdo a diversos alimentos.
Varia de acuerdo a diversos alimentos.
Cuando el PH de la saliva disminuye y esa disminución se mantiene en el tiempo empezamos a ver síntomas como caries de cuello, reseción gingival, milolisis, desmineralización en el cuello, manchas blanquecinas en el esmalte .
pH del sudor:
Sudor humano 5.5 pH. Sin embargo esto varia según la edad. Típicamente los recién nacidos tienen un pH mas cercano al neutral (el pH 7) que rápidamente da vuelta ácido para proteger la piel de los niños jóvenes.
El sudor forma en la piel una capa protectora que puede proteger de los patógenos. Por lo cual si este se ve afectado, podría provocar enfermedades.
Referencias:
http://quimica1general1.blogspot.mx/2008/06/el-qumico-dans-slp-stirensen.html
http://phacidez.blogspot.mx/p/definicion-del-ph.html
https://es.wikipedia.org/wiki/PH
http://www.eucerin.es/acerca-de-la-piel/conocimientos-basicos-sobre-la-piel/pH-de-la-piel
http://www.saberia.com/2011/12/que-es-el-ph-de-la-piel/
https://www.nlm.nih.gov/medlineplus/spanish/ency/article/003883.htm
http://www.ehowenespanol.com/ph-del-acido-del-estomago-sobre_167170/
http://www.sandranews.com/que-es-el-ph-de-la-saliva/
http://bienestar.salud180.com/salud-dia-dia/que-es-y-para-que-sirve-el-ph-de-la-saliva#imagen-2
http://es.slideshare.net/claudiaruezga/la-saliva-16626481
http://es.slideshare.net/JorgeValarezo1/el-ph-31039004
http://brainly.lat/tarea/104257
http://quimica1general1.blogspot.mx/2008/06/el-qumico-dans-slp-stirensen.html
http://phacidez.blogspot.mx/p/definicion-del-ph.html
https://es.wikipedia.org/wiki/PH
http://www.eucerin.es/acerca-de-la-piel/conocimientos-basicos-sobre-la-piel/pH-de-la-piel
http://www.saberia.com/2011/12/que-es-el-ph-de-la-piel/
https://www.nlm.nih.gov/medlineplus/spanish/ency/article/003883.htm
http://www.ehowenespanol.com/ph-del-acido-del-estomago-sobre_167170/
http://www.sandranews.com/que-es-el-ph-de-la-saliva/
http://bienestar.salud180.com/salud-dia-dia/que-es-y-para-que-sirve-el-ph-de-la-saliva#imagen-2
http://es.slideshare.net/claudiaruezga/la-saliva-16626481
http://es.slideshare.net/JorgeValarezo1/el-ph-31039004
http://brainly.lat/tarea/104257
MATERIAL:
- 12 cucharas desechables.
- 12 vasos desechables transparentes.
- 1 vaso de precipitado.
- Marcador permanente.
SUSTANCIAS:
- Equipo 1: Agua destilada o agua inyectable y vinagre de chiles.
- Equipo 2: bicarbonato de sodio y alka-seltzer
- Equipo 3: Jugo de frutas procesado sabor durazno y leche entera.
- Equipo 4: ´Sprite o 7 Up y bebida energética vive 100.
- Equipo 5: Pastillas de vitamina C y pinol.
- Equipo 6: Jabón líquido transparente y limones.
NOTA: Cada equipo traerá la sustancias asignadas para todos los equipos.
PROCEDIMIENTO:
- Numera los vasos del 1 al 12.
- Agrega 50 ml de agua de la llave a cada vaso.
- Vacíen una muestra de cada sustancia a examinar, una distinta en cada vaso y mezclen bien.
- Agreguen 2 cucharadas del indicador natural a cada vaso y mezclen con una cuchara limpia.
- Registren sus observaciones en la tabla siguiente:
Vaso
|
Sustancia
|
color inicial
|
color final
|
pH aproximado
|
1
|
Agua destilada
| Incolora | Verde | 7 |
2
|
vinagre
| Amarillo | Naranja (naranja "toronja") | 2 |
3
|
bicarbonato de sodio
| Grisaceo | Verde | 8 |
4
|
Alka-seltzer
| Incoloro | Lila | 13 |
5
|
Jugo de frutas
| Amarillo | Naranja | 3 |
6
|
Leche entera
| Blanco | Blanco | Blanco |
7
|
Refresco
| Incolora | Morado | 14 |
8
|
Bebida energética
| Amarilla | Naranja | 2 |
9
|
Vitamina C
| Arena | Durazno | 0 |
10
|
Pinol
| Blanco opaco | Verde limón | 6 |
11
|
Jabón líquido
| Blanco opaco | Verde | 8 |
12
|
Jugo de limón
| Verde opaco | Fiusha | 1 |
13 Saliva Incolora Azul - Lila 9 -12
Todas las salivas del equipo salieron de color azul en un rango de entre 9 a 12 escala pH.
OBSERVACIONES (IMÁGENES Y DESCRIPCIÓN):
Todas las salivas del equipo salieron de color azul en un rango de entre 9 a 12 escala pH.
OBSERVACIONES (IMÁGENES Y DESCRIPCIÓN):
Primero se enumeraron del 1 al 12 los vasos, luego a cada uno de ellos se le colocaron 50ml de agua, para después vertirles una muestra de cada sustancia a examinar, y luego las mezclamos con las cucharas (como se muestra en las imágenes).
Y en base a como se veían los vasos en ese momento contestamos la primera columna de la tabla.
Aquí se puede ver como es que molimos las pastillas (Alka-seltzer y la de vitamina C, respectivamente) para despues agregarlas a los vasos 4 y 9 como indica la tabla.
Luego, la maestra nos dio el indicador con el cual detectaríamos si las sustancias eran ácidos o bases.
Después a cada uno de los vasos le agregamos dos cucharas del indicador, para ver a que color cambiaban.
Así fue como quedaron las sustancias después de haberles agregado las dos cucharadas del indicador, y fue así como pudimos identificar, en base a la tabla de pH, cuales pertenencian a los ácidos y cuales a las bases.
Lo mismo hicimos con la saliva de cada uno de los integrantes del equipo. Les colocamos el indicador y vimos como cambian de color, para así poderlas ubicar en la escala de pH.
Y como se podrá ver, todas salieron entre colores azules o lilas.
Luego, la maestra nos dio el indicador con el cual detectaríamos si las sustancias eran ácidos o bases.
Después a cada uno de los vasos le agregamos dos cucharas del indicador, para ver a que color cambiaban.
Así fue como quedaron las sustancias después de haberles agregado las dos cucharadas del indicador, y fue así como pudimos identificar, en base a la tabla de pH, cuales pertenencian a los ácidos y cuales a las bases.
Lo mismo hicimos con la saliva de cada uno de los integrantes del equipo. Les colocamos el indicador y vimos como cambian de color, para así poderlas ubicar en la escala de pH.
Y como se podrá ver, todas salieron entre colores azules o lilas.
ANÁLISIS:
1.-De acuerdo con la escala de pH para la col morada clasifica las sustancias en ácidas y básicas.
Ácidos: Jugo de limón, pinol, bebida energética, vinagre y jugo de frutas.
Bases: Refresco, jabón líquido, agua destilada, bicarbonato de sodio, alka-seltzer.
2.-Ahora acomodalas de acuerdo a la escala de pH de la col morada desde el 14 hasta el 0 y haz una lista.
- Vitamina C
- Jugo de limón
- Vinagre
- Bebida energetica
- Jugo de frutas
- Pinol
- Agua destilada
- Bicarbonato de sodio
- Jabón Líquido
- Alka-selzer
- Refresco
3.-¿Qué aplicación práctica le encuentran a este experimento? Es una ayuda a distinguir entre las sustancias base y las ácidas, ya que algunas de las mas ácidas llegan a ser perjudiciales para la salud.
CONCLUSIÓN:
Debido a las propiedades de cada una de las sustancias con las que trabajamos, experimentamos variaciones en el color al momento de agregarles el indicador (que en este caso era la col morada) y así pudimos diferenciar entre un ácido y una base de acuerdo a la escala de pH.
Debido a las propiedades de cada una de las sustancias con las que trabajamos, experimentamos variaciones en el color al momento de agregarles el indicador (que en este caso era la col morada) y así pudimos diferenciar entre un ácido y una base de acuerdo a la escala de pH.

![\mbox{pH} = -\log_{10} \left[ \mbox{a}_{H^+} \right]](https://upload.wikimedia.org/math/e/8/4/e848c73dfb8ed8216892207b39eacc2d.png)










No hay comentarios.:
Publicar un comentario