NOMBRE
|
NÚMERO DE LISTA
|
LINKS DE SU BLOG.
|
Lizeth Jazmín Montoya Torres
|
21
|
http://3clizethmontoyat22.blogspot.mx/
|
Salvador Osorio Gonzalez
|
22
|
http://3csalvadorosoriog23.blogspot.mx/
|
Michelle Alejandra Perez de Lara
|
23
|
http://3cmichelleperez24.blogspot.mx/
|
Mariana Valeria Pichardo Muñoz
|
24
| |
Alejandro Plascencia Romo
|
25
|
http://3calejandroplascenciar26.blogspot.mx/
|
Paula Daniela Quezada Delgado
|
26
| |
Luisa Fernanda Ramirez Andrade
| 27 |
http://3cluisaramireza28.blogspot.mx/
|
FECHA DE REALIZACIÓN:
4 de Noviembre del 2015
OBJETIVO:
Comprobar la ley de la Conservación de la materia o la masa.
HIPÓTESIS:
Se piensa que la masa quedara igual, ya que se producirá una reacción química en un espacio cerrado, por lo tanto no se debe modificar lo que esta adentro.
INVESTIGACIÓN:
Definan conceptos: materia, masa.
Que usos se le da a la ley de la Conservación de la materia y cuál es su importancia.
Masa es un concepto que identifica a aquella magnitud de carácter físico que permite indicar la cantidad de materia contenida en un cuerpo. Dentro del Sistema Internacional, su unidad es el kilogramo (kg.).
 NOTA: No debe confundirse con el peso, que es una magnitud vectorial que representa una fuerza cuya unidad utilizada en el Sistema Internacional de Unidades es el newton (N). Tampoco debe confundirse con la cantidad de sustancia, cuya unidad en el Sistema Internacional de Unidades es el mol.
NOTA: No debe confundirse con el peso, que es una magnitud vectorial que representa una fuerza cuya unidad utilizada en el Sistema Internacional de Unidades es el newton (N). Tampoco debe confundirse con la cantidad de sustancia, cuya unidad en el Sistema Internacional de Unidades es el mol.LEY DE LA CONSERVACIÓN DE LA MATERIA:
La Ley de conservación de la masa o ley de conservación de la materia es una de las leyes fundamentales en todas las ciencias naturales. Fue elaborada por Lavoisier y otros científicos que le sucedieron. Establece un punto muy importante: “En toda reacción química la masa se conserva, es decir, la masa consumida de los reactivos es igual a la masa obtenida de los productos”.
Ejemplos de la ley de conservación de la materia en la vida cotidiana:
La combustión: Si se queman 10 gramos de papel se obtiene .1 gramos de cenizas y 9.9 gramos de gases productos de la combustión que son liberados.
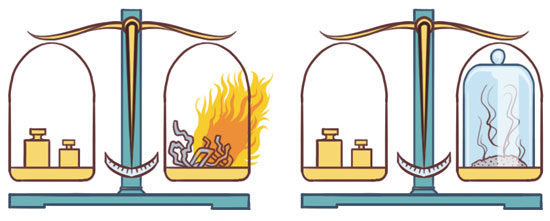
La ebullición: Si se hierve un Kilogramo de agua en estado líquido durante el tiempo suficiente para que se consuma, se obtendrá un Kilogramo de vapor.

Si a un automóvil se le carga con 20 Kilogramos de combustible, después de haber encendido el motor durante un tiempo y de que se haya consumido todo el combustible, el auto pesará 20 Kilogramos menos, pero en la atmósfera habrá 20 Kilogramos más de gases producto de la combustión.

Esta ley tiene una importancia fundamental ya que permite extraer componentes específicos de alguna materia prima sin tener que desechar el resto; también es importante debido a que nos permite obtener elementos puros, cosa que sería imposible si la materia se destruyera.

Esta ley tiene una importancia fundamental ya que permite extraer componentes específicos de alguna materia prima sin tener que desechar el resto; también es importante debido a que nos permite obtener elementos puros, cosa que sería imposible si la materia se destruyera.
Referencias:
https://es.wikipedia.org/wiki/Masa
http://definicion.de/masa/
https://es.wikipedia.org/wiki/Materiahttp://www.ejemplosde.com/37-fisica/1278-ejemplo_de_ley_de_la_conservacion_de_la_materia.html
http://www.buenastareas.com/ensayos/Conservacion-De-La-Materia/183378.html
MATERIAL:
- Embudo de plástico.
- Probeta de 250 ml.
- Balanza granataria.
- Matraz Erlenmeyer.
- Globo mediano.
- Masking tape.
- Espátula.
SUSTANCIA:
- Bicarbonato de sodio.
- Vinagre de manzana o caña.
PROCEDIMIENTO:
- Con ayuda del embudo, depositen en el globo dos cucharadas de bicarbonato de sodio.Aqui se muestra como es que colocamos el globo en el embudo, para posteriormente agregar las dos cucharadas de bicarbonato de sodio.
- Midan 100 ml de vinagre y viértanlos en el matraz erlenmeyer y, después cubran su boca con el globo y asegurenlo con masking tape. Háganlo con cuidado, de manera que el contenido del globo no caiga en el interior de la botella.
Después de poner las dos cucharadas de bicarbonato de sodio en el globo, lo pegamos con masking tape a la boca del matraz erlenmeyer sin que el contenido cayera al interior de este.
- Acomoden el dispositivo (el matraz con el globo) sobre la balanza y determinen su masa. Registren el dato.Pesamos el matraz con 100ml de vinagre y el globo pegado en su boca. Peso 273.5gr
- Con cuidado, vacíen el contenido del globo en el interior de la botella, dejen pasar 5 minutos y pesen de nuevo el dispositivo. Registren el dato.
Aqui se puede apresiar claramente cuando vaciamos el bicarbonato de sodio al vinagre.
Cuando vertimos el bicarbonato dentro del matraz con el vinagre.
Esperamos 5min. y luego pesamos nuevamente en recipiente. Peso 268.7gr
OBSERVACIONES (IMÁGENES Y DESCRIPCIÓN)
Si ocurrió la reacción química entre el bicarbonato de sodio el vinagre como lo habíamos planeado, pero no pensamos que fuera a disminuir la masa de el sistema, ya que según nosotros estaban en un sistema cerrado.
Antes y después de el experimento.
- ¿Qué explicación darían del fenómeno observado? Al momento de mezclar el bicarbonato de sodio con el vinagre, se crea una reacción la cual da como resultado el desprendimiento de un gas lo cual es lo que al final infla el globo.
El bicarbonato de sodio actúa como una base frente al vinagre (ácido acético) y se produce la neutralización (total o parcial).
Se desprende dióxido de carbono (el burbujeo ese que sale con espuma y todo).
También se obtiene agua y acetato de sodio.
La reacción es:
NaHCO3 + CH3COOH = CH3COONa + CO2 + H2O - ¿Hubo alguna variación en la masa de la botella con el globo antes y después de la reacción química? Si. ¿Cómo explicarían lo anterior? Tal vez porque no lo realizamos bien, porque según los cálculos debió de haber quedado igual la masa de un inicio en comparación con la de el final, ya que si estamos trabajando con un sistema cerrado, nada entra, ni nada sale.
- ¿consideran que trabajaron con un sistema cerrado? ¿por qué? Si, porque sellamos muy bien la boca del matraz con el globo y así no se pudo haber escapado nada (bueno tal ves si, por los pequeños orificios que tiene el globo, pero se debió haber escapado casi nada).
- ¿Cuál fue la importancia de hacer mediciones precisas durante este experimento? El de evitar confusiones así como para obtener datos precisos.
- ¿Qué relación es posible establecer entre esta actividad y la experiencia de Lavoisier? En que se tuvo que medir detalladamente el sistema, así como registrar todos los datos y comprobar que con diferentes ambientes la masa cambia.
CONCLUSIÓN:
Tal como se dice en la ley de la conservación de la materia: "En un ambiente cerrado la masa permanece constante" en el caso del experimento la masa se redujo porque quizá algún elemento del laboratorio se volatizo o no produjo reacción, ya que en sí no estaba en un ambiente cerrado, sin embargo no fue mucha la diferencia.












No hay comentarios.:
Publicar un comentario